Resumen:
Desde diciembre de 2019, SARS-CoV-2 ha provocado la muerte de casi un millón y medio de personas. La única forma de contener el avance de la pandemia será a través de una vacuna que logre conferir inmunidad en la población y sea segura. A menos de 1 año del primer caso de COVID-19, existen más de 200 vacunas en desarrollo y diez de estas vacunas ya se encuentran en la fase 3 de ensayo clínico. Además de ser bien toleradas e inducir una adecuada respuesta inmunológica, algunas de estas vacunas ya han demostrado ser eficaces previniendo la aparición de síntomas clínicos, principalmente aquellos síntomas severos asociados con la COVID-19. En el mediano y largo plazo, la inmunidad poblacional conferida a través de la vacunación masiva, permitirá contener la circulación del virus y controlar la pandemia. Sin embargo, los expertos coinciden que necesitaremos de otras herramientas terapéuticas y profilácticas que protejan a la población – principalmente a los grupos de riesgo - en un futuro inmediato. El presente artículo tiene como objetivo explicar en un lenguaje llano cuáles son las características de las vacunas que se encuentran en este estadio, haciendo foco en aquellas que planean utilizarse en la Argentina. Asimismo, se describen los mecanismos inmunológicos básicos que participan de la respuesta inmune contra el SARS-CoV-2. Finalmente, se discute de qué manera la administración de anticuerpos monoclonales dirigidos contra la proteína S de SARS-CoV-2 lograrían proteger a los grupos de riesgo en el corto plazo.
Abstract:
SARS-CoV-2 has caused more than 1 million deaths worldwide and this amount is expected to increase during the following months. Experts in this field agree that a safe and effective vaccine will be necessary to contain this pandemic. Currently, more than 200 vaccines against SARS-CoV-2 are in development and some candidates are already in phase 3 clinical trials in humans. Here, I use a plain language to explain to the general community the most relevant features of anti-SARS-CoV-2 vaccines that reached phase 3 stage, focusing on those that are planned to be used in Argentina. Additionally, I describe the basics of immunity to SARS-CoV-2. Finally, I explain how passive administration of monoclonal antibodies targeting SARS-CoV-2 S protein could aid to control the COVID-19 pandemic.
Keywords:
SARS-CoV-2; COVID-19; Vaccines; Immunity; Neutralizing antibodies; mAbs
SARS-CoV-2 y COVID-19
El SARS-CoV-2 (del inglés severe acute respiratory syndrome coronavirus 2; de aquí en más referido como SARS2), agente causal de la COVID-19 (del inglés, coronavirus disease 2019), es el tercer coronavirus de origen animal (zoonótico) que ha desencadenado una pandemia en lo que va del siglo XXI, siendo los dos anteriores SARS y MERS [1,2]. La causa principal del salto de estos virus, desde su especie hospedadora natural al hombre, es la presión ejercida por este último sobre los ecosistemas en los que habitan sus hospedadores naturales (Ej., murciélagos, camélidos, etc.). Comparado con SARS y MERS, la letalidad (% muertos sobre el total de infectados) del SARS2 es menor. Sin embargo, debido a la elevada tasa de transmisión que posee el SARS2, el número de muertes provocado por SARS2 (1.25 millones) ha sido significativamente mayor que la de sus antecesores [3]. Además de estos tres coronavirus pandémicos, existen otros cuatro coronavirus que circulan desde hace muchos años en la población humana (endémicos). Estos últimos son responsables de los resfríos comunes.
Cuando un virus ingresa a un organismo u hospedador, éste, ataca a un (o varios) tipo particular de células blanco, en las cuales el virus se multiplica. Debido a que este paso es necesario para producir la progenie o descendencia viral, los virus son considerados parásitos intracelulares obligados. El ingreso a la célula blanco se produce por medio de la interacción entre una proteína que posee el virus en su superficie (proteína S o Spike, en el caso de SARS2) y una proteína que se encuentra presente normalmente en las células blanco del hospedador (esta proteína también se conoce como receptor, ACE2 en el caso de SARS y SARS2 [4,5]). ACE2 es una molécula involucrada normalmente en la regulación de la presión sanguínea. Una vez dentro de la célula blanco el virus libera su información genética (ARN o ADN) y utiliza las enzimas celulares (y/o propias) para sintetizar las proteínas y material genético que formarán los nuevos virus (progenie). Una célula infectada puede producir miles de virus nuevos que, a su vez, tienen la capacidad de infectar nuevas células. Cuando los virus infectan células en contacto directo con el exterior (Ej. Mucosa de las vías aéreas) la progenie viral se libera hacia el medio ambiente, permitiendo la transmisión de virus a otra persona sana.
Por su parte, cuando un organismo es atacado por un patógeno (Ej, virus, parásito o bacteria), el sistema inmune censa la agresión por medio de un tipo especializado de células denominado célula presentadora de antígeno (APC). Estas células son encargadas de (i) activar la respuesta inmune innata o temprana y (ii) activar la respuesta inmune adaptativa. Los linfocitos T helper son los encargados de coordinar la respuesta inmune adaptativa, y ésta culmina en la producción de células especializadas en la destrucción de células infectadas con el virus (respuesta inmune celular) y la producción de anticuerpos, capaces de neutralizar al virus (respuesta inmune humoral). La respuesta orquestada de todos estos componentes inmunes logra contener las infecciones en la mayoría de los casos (Figura 1). La respuesta inmune adaptativa (humoral y celular) tiene memoria, es decir que recuerda los diferentes patógenos con los que ha combatido y es, además, altamente especifica. En general, los recién nacidos (hasta el año de vida) y adultos mayores están limitados en la producción de una respuesta inmune robusta y es por ello que requieren especial cuidado a la hora de prevenir o tratar ciertas infecciones virales.
Figura 1. Infección por SARS-CoV-2, respuesta inmune y vacunas. Resaltado en rojo se muestran los tipos de vacunas que alcanzaron la fase 3 de prueba en humanos.
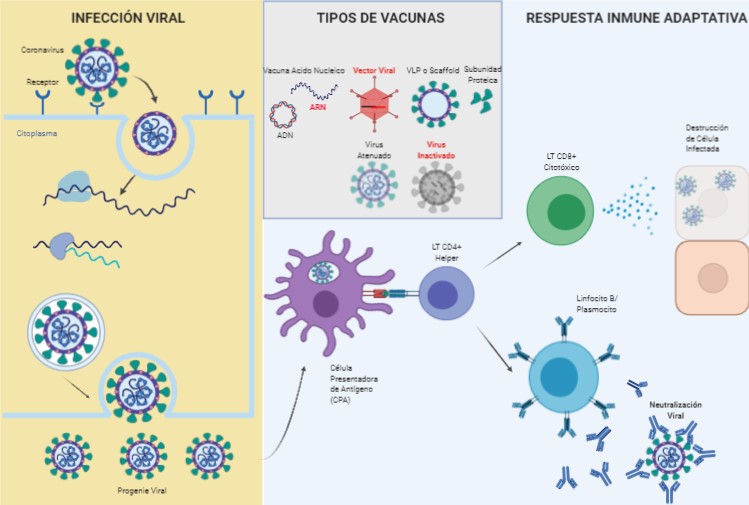
El 80% de las infecciones causadas por SARS2 son asintomáticas o cursan con signos leves. El 20% restante son infecciones moderadas, requiriendo en algunos casos (5-10%), internación en cuidados intensivos y suministro de respiración asistida [6,7]. Los casos severos de COVID-19 se caracterizan por una replicación viral aguda muy alta, desencadenando la liberación desmedida de mediadores inmunes, los que provocan una desregulación inmunológica, cuadro inflamatorio y coagulopatía [8–10] . Debido a que la replicación viral se produce principalmente a nivel pulmonar, los cuadros severos se caracterizan por el desarrollo de una neumonía aguda; aunque la falla multiorgánica (renal, digestiva, corazón, SNC) son también comunes. Algunos factores asociados con cuadros severos de COVID-19 son edad avanzada, sexo (masculino), diabetes, problemas cardiorespiratorios y renales pre-existentes, obesidad, entre otros. Los niños, aunque suelen presentar manifestaciones clínicas leves, se infectan y transmiten el virus de igual manera que los adultos.
Las personas infectadas con SARS2 pueden o no presentar síntomas. Sin embargo, todos transmiten virus. En los casos sintomáticos, los signos clínicos se desarrollan entre los días 2 y 7, luego de producido el contagio. Las personas pueden transmitir el SARS2, incluso antes de que los síntomas hayan aparecido [11–13]. Esto, junto a la capacidad que tiene SARS2 de replicar en las vías aéreas superiores, hacen que la transmisibilidad de éste sea mayor a la de SARS y MERS. Las personas infectadas con SARS2, producen anticuerpos específicos contra la proteína S de SARS2 a partir de las primeras 2 semanas de aparición de los síntomas [14,15]. Los pacientes infectados con SARS2 también producen respuestas inmunes celulares especificas contra el virus [16]. Aún no se ha determinado cuanto tiempo dura la inmunidad generada luego de que un individuo se recupera de la COVID-19. La duración de la respuesta inmune podría ser variable entre distintos individuos. Algunos estudios señalan que ésta, podría no ser muy prolongada. Posiblemente la duración de la respuesta celular sea mayor que la humoral. Estas cuestiones son de importancia al momento de entender los fenómenos de reinfección y definir protocolos de vacunación, como veremos a continuación.
Vacunas: Conceptos generales.
A diferencia de la respuesta inmune innata (primera defensa), la respuesta inmune adaptativa (humoral/anticuerpos y celular) posee memoria y esto le permite aprender a reconocer patógenos nuevos. Cuando un individuo se infecta por segunda vez con un mismo patógeno, el sistema inmune responde más rápido y de forma más potente. En consecuencia, las re-infecciones suelen transcurrir con consecuencias clínicas menores (salvo algunas excepciones particulares). Las vacunas explotan este fenómeno de “memoria”, estimulando el desarrollo de memoria inmunológica específica contra diversos microorganismos/patógenos, generando anticuerpos y células de memoria de larga vida, sin necesidad de transitar por la infección primaria. De esta manera, las vacunas que recibimos a lo largo de nuestra vida, nos preparan para un eventual encuentro contra diversos microorganismos, logrando minimizar los riesgos asociados con las enfermedades provocadas por ellos.
Ciertas vacunas como la de la hepatitis B confieren protección a través de la producción de anticuerpos, mientras que otras lo hacen a través de inducción de células de memoria (Ej BCG). Algunas vacunas pueden generar una mezcla de ambas respuestas inmunes (celular y humoral). El tipo de respuesta está relacionado con el tipo de componente que utiliza la vacuna. Las vacunas a virus inactivado o a subunidad proteica suelen inducir anticuerpos en mayor medida que respuesta celular; mientras que las de virus atenuados, vectores virales y ácidos nucleicos, suelen generar una combinación de respuesta humoral (anticuerpos) y celular.
La vacuna ideal es aquella que provee una protección completa. Es decir que el individuo vacunado no se infecta al contactar con el patógeno. Sin embargo, la mayoría de las vacunas no proveen este tipo de protección, pero si logran disminuir la sintomatología clínica, la replicación viral y por ende la transmisibilidad o contagio, controlando de esta forma la propagación del agente en la población. El éxito de una campaña de vacunación contra un patógeno particular está dado por el nivel de inmunización que alcanza la población. Éste, a su vez depende de la potencia de la vacuna (cuantos de los individuos vacunados están protegidos) y la proporción de la población que se vacuna (cobertura). Estas cifras nunca alcanzan el 100%. Si el nivel de protección de una vacuna fuese del 80% y se vacunase el 80% de la población, se lograría inmunidad en un 64% de la población. Para contener una pandemia de las características de COVID-19 se estima que sería necesario un nivel de inmunidad poblacional cercano al 70%.
Panduan Lengkap Situs Slot Gacor: Tips untuk Menang dengan Mudah
Mencari situs slot terpercaya dan mudah menang bukanlah tugas yang sederhana, terutama dengan banyaknya pilihan platform yang tersedia di internet. Namun, Anda berada di tempat yang tepat! Artikel ini akan membantu Anda memahami cara memilih situs slot terbaik yang menawarkan pengalaman bermain menyenangkan sekaligus peluang menang yang besar. Baik Anda seorang pemain berpengalaman maupun pemula, panduan ini dirancang untuk membuat perjalanan bermain slot Anda lebih maksimal.
Mari kita bahas apa saja yang membuat sebuah situs slot layak dimainkan dan bagaimana Anda bisa mendapatkan keuntungan maksimal dari waktu serta uang Anda.
Apa yang Membuat Sebuah Situs Slot Layak Dicoba?
Sebuah situs slot yang baik harus memiliki sejumlah keunggulan yang menjadikannya pilihan tepat. Berikut adalah poin-poin yang perlu diperhatikan:
- Antarmuka Ramah Pengguna: Situs yang dirancang dengan baik dan mudah digunakan di perangkat apa pun, baik desktop maupun ponsel, dengan navigasi yang sederhana untuk menemukan game favorit dengan cepat.
- Pilihan Game yang Beragam: Akses ke ribuan game slot gacor menarik dengan tema dan fitur unik. Permainan dari pengembang terpercaya dengan kualitas grafis dan suara terbaik.
- Keamanan dan Transparansi: Lisensi resmi dari otoritas game yang diakui, serta sistem permainan adil dengan teknologi Random Number Generator (RNG).
- Bonus dan Deposit Terjangkau: Modal awal rendah, beberapa situs bahkan memungkinkan bermain hanya dengan Rp10.000, serta bonus menarik seperti putaran gratis, cashback, dan promosi lainnya.
- Layanan Pelanggan Responsif: Dukungan 24 jam yang dapat diakses melalui live chat, email, atau telepon, dengan tim yang siap membantu kapan saja.
Tips Memilih Situs Slot Gacor Terbaik
Jika Anda masih bingung memilih situs yang tepat, berikut beberapa langkah yang dapat membantu:
- Periksa Pembaruan Game Terbaru: Situs terbaik selalu menghadirkan permainan baru secara berkala untuk menjaga antusiasme pemain. Pastikan situs menawarkan kombinasi game klasik, video slot, dan jackpot progresif.
- Bandingkan Penawaran Bonus: Lihat bonus sambutan, promosi harian, dan program loyalitas. Pastikan syarat dan ketentuan bonus tidak terlalu rumit untuk dipenuhi.
- Tinjau Metode Pembayaran: Cari situs yang menawarkan berbagai opsi pembayaran, mulai dari transfer bank, dompet digital, hingga mata uang kripto. Pastikan proses transaksi cepat dan biaya administrasi rendah.
- Baca Ulasan Pemain: Cari tahu pengalaman pemain lain terkait keandalan situs, kecepatan pembayaran, dan layanan pelanggan. Fokus pada ulasan yang membahas kejujuran dan kenyamanan bermain.
- Coba Versi Demo: Banyak situs menawarkan mode demo untuk mencoba permainan secara gratis. Gunakan kesempatan ini untuk memahami fitur game. Pastikan versi mobile-nya bekerja dengan baik untuk permainan saat bepergian.
Mengapa Memilih Situs Slot Populer?
Situs slot yang terkenal dan populer biasanya memiliki beberapa keunggulan dibandingkan situs biasa. Berikut alasannya:
- Varian Game Lebih Baik: Platform terkenal bekerja sama dengan pengembang terkemuka seperti Pragmatic Play, Microgaming, dan NetEnt, sehingga Anda dapat menemukan game terkini dengan tema yang kreatif dan fitur menarik.
- Keamanan Lebih Terjamin: Situs terpercaya menggunakan enkripsi canggih untuk melindungi data pribadi dan keuangan Anda, serta mematuhi standar regulasi yang ketat.
- Komunitas Pemain Aktif: Platform populer sering memiliki komunitas pemain yang aktif, tempat Anda bisa berbagi tips dan trik. Partisipasi dalam turnamen atau kompetisi leaderboard juga memberikan peluang hadiah tambahan.
Cara Maksimalkan Peluang Menang
Meskipun bermain slot sebagian besar mengandalkan keberuntungan, ada beberapa strategi yang bisa membantu Anda meningkatkan peluang menang. Berikut tipsnya:
- Mulai dengan Taruhan Kecil: Mulailah dengan taruhan rendah untuk mempelajari permainan tanpa terlalu banyak risiko. Tingkatkan taruhan Anda secara bertahap saat Anda mulai memahami pola permainan.
- Pilih Game dengan RTP Tinggi: RTP (Return to Player) adalah persentase uang yang dikembalikan game kepada pemain dalam jangka panjang. Pilih game dengan RTP 95% atau lebih tinggi untuk peluang menang lebih besar.
- Manfaatkan Bonus dan Putaran Gratis: Banyak situs menawarkan putaran gratis sebagai bagian dari promosi. Gunakan ini untuk mencoba permainan tanpa biaya tambahan.
- Tetapkan Batas: Tentukan anggaran sebelum bermain dan patuhi batas tersebut. Buat batasan kemenangan dan kekalahan untuk menghindari kerugian besar.
- Mainkan di Jam Sepi: Beberapa pemain percaya bahwa peluang menang lebih besar saat bermain di jam-jam yang kurang ramai. Cobalah untuk melihat apakah ini efektif bagi Anda.
- Konsisten dan Sabar: Konsistensi adalah kunci. Bermain secara rutin dapat membantu Anda memahami mekanisme permainan dengan lebih baik.
Keunggulan Bermain Judi Bola Online dengan Modal Kecil
Salah satu alasan utama mengapa banyak orang menyukai agen bola online adalah karena modal awal yang terjangkau. Inilah keuntungannya:
- Eksplorasi Bebas Risiko: Anda bisa mencoba berbagai permainan tanpa perlu mengeluarkan banyak uang.
- Hiburan Ramah Kantong: Dengan modal kecil, Anda tetap bisa menikmati permainan yang seru dan menyenangkan.
- Pengembangan Strategi: Bermain dengan taruhan kecil memberi Anda kesempatan untuk mengasah strategi tanpa tekanan besar.
Desarrollo, producción y aprobación de vacunas.
El proceso de desarrollo de una nueva vacuna es complejo y consta de varias etapas: Etapa de exploración y desarrollo, etapa preclínica (pruebas de seguridad y potencia en animales), etapa clínica (pruebas de seguridad y eficacia/potencia en humanos), revisión de regulación y aprobación, producción a gran escala, control de calidad y monitoreo [17]. Por su parte los ensayos clínicos en pacientes poseen 3 fases: durante la fase 1, pequeños grupos de personas (menos de 100 individuos) reciben la vacuna para evaluar la aparición de efectos adversos; durante la fase 2, los grupos de personas se expanden (menos de 1000 individuos) agregando grupos con ciertas características particulares (enfermedades pre-existentes, edad avanzada, etc.), también se evalúa indirectamente (inmunidad generada, nivel de anticuerpos post-vacunación) la efectividad preliminar, dosis y vía de administración; durante la fase 3, la vacuna se aplica a grandes grupos (decenas de miles) para verificar la ausencia de efectos adversos poco frecuentes, así como también poder determinar la eficacia real de la vacuna comparando el nivel de infección en grupos vacunados con aquellos que recibieron placebo. Para que una vacuna sea aprobada, la misma, debe atravesar exitosamente todas estas instancias. Además, el productor debe compartir los resultados de sus estudios con los organismos reguladores (nacionales e internacionales), además de acreditar buenas prácticas de producción. También debe someterse a inspecciones externas tanto de planta como de producto final. Es importante resaltar que, es el organismo regulatorio de cada país, en consenso con los lineamientos de la OMS (organización mundial de la salud) quien aprueba o rechaza una vacuna particular. Finalmente, se realiza un monitoreo constante de la producción y desempeño de la vacuna a lo largo del tiempo.
Vacunas contra SARS-CoV-2
En conjunto el proceso de desarrollo y producción demora de 5 a 15 años. Sin embargo, gracias a un esfuerzo sin precedentes, con coparticipación de diversas instituciones públicas (know-how) y el sector privado (capacidad de producción a escala bajo buenas normas) ha permitido que en menos de 1 año desde el comienzo de la pandemia de COVID-19 existan más de 200 vacunas en investigación, que diez de estas vacunas hayan entrado ya en la fase 3 de ensayos clínicos y que una de ellas ya haya solicitado aprobación para su uso de emergencia. Es importante destacar que estos resultados fueron posibles gracias al trabajo titánico de consorcios académicos compuestos por expertos inmunólogos y virólogos de diversas instituciones internacionales, que, adaptando plataformas tecnológicas de última generación hacia este nuevo patógeno, lograron completar las etapas de exploración y de fase pre-clínica en tiempo record (de 3 a 6 meses). Muchos de estos grupos trabajaban en HIV, influenza, Ebola, MERS, etc. Por otra parte, se cambió el tradicional sistema lineal de testeo clínico y producción por uno solapado, donde todas las fases y la producción se desarrollan en forma conjunta, pasando de una etapa a la siguiente, una vez que los niveles de seguridad de cada etapa son garantizados. Debido a que esta nueva modalidad no saltea ninguna de las etapas de control, este sistema no acarrea un mayor riesgo para la salud, sino que el riesgo recae sobre el capital de inversión. Ya que se prioriza la seguridad del principio activo antes que su eficacia. Y si al finalizar la fase 3 la vacuna no es efectiva, toda la producción masiva deberá ser descartada.
La Tabla 1 muestra las vacunas que ya han alcanzado la fase clínica de prueba 3. De ellas, 4 han sido o serán testeadas en Argentina, las producidas por Sinopharm (virus inactivado), Pfizer/BioNtech (ARNm), J&J (virus recombinante), CanSino (virus recombinante). Por su parte el MinSal.gob ha reservado partidas de las vacunas de AstraZeneca por 22 millones (virus recombinante, producida localmente por grupo Sigman/Mabxience), Sputnik V por 25 millones (virus recombinante) y Pfizer/BioNtech por 3 millones. Su adquisición y utilización están supeditadas a los resultados que arrojen los ensayos de fase 3 y su posterior aprobación por ANMAT de Argentina.
Tabla 1. Vacunas contra COVID-19 en fase clínica 3
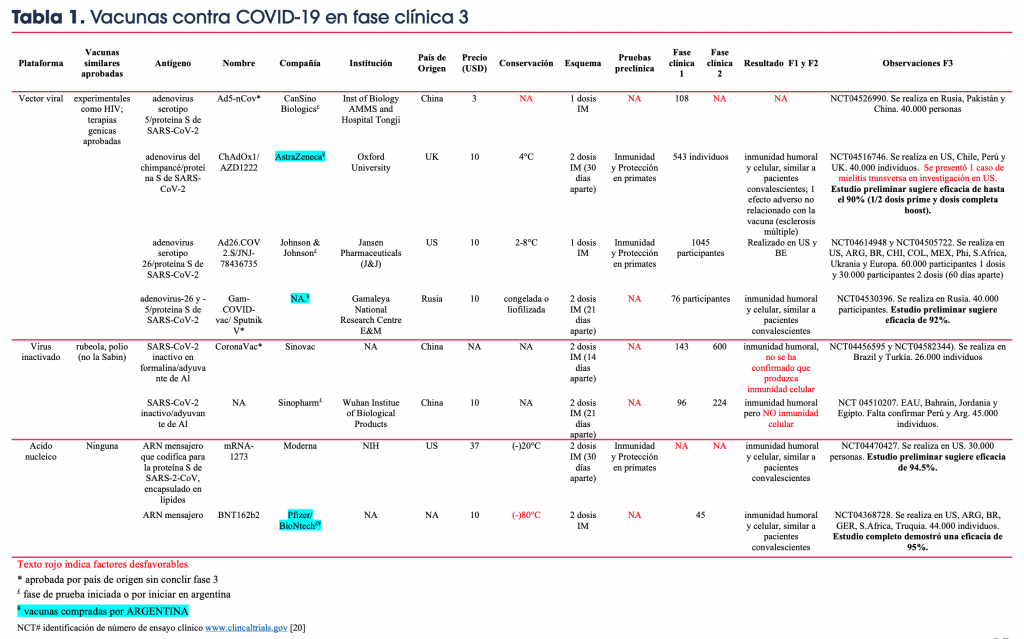
Vacunas contra COVID-19 en Argentina
El gobierno argentino ha reservado millones de dosis de tres vacunas diferentes: La ChAdOx1/AZD122, desarrollada por Oxford University (UK) y producida por AstraZeneca; en el país será producida por Mabxience. La Sputnik V, desarrollada y producida por el Centro Nacional de Investigación Gamaleya (Rusia). Ambas vacunas utilizan un vector viral similar (Adenovirus no replicante) para transportar y presentar al sistema inmune la proteína S de SARS2. Hasta el día de la fecha, una única vacuna aprobada utiliza esta plataforma (vacuna Ebola). Existen, además, numerosas vacunas experimentales que la emplean. La principal ventaja de estas vacunas es que poseen la capacidad de inducir inmunidad humoral (anticuerpos) y celular. Generalmente se utilizan dos aplicaciones intramusculares y deben ser conservadas en frio o congeladas a -20C. Sputnik V tendría la ventaja de comercializarse liofilizada a temperatura ambiente.
Por otra parte, la BNT162b2 desarrollada y producida por Pfizer en colaboración con BioNtech, es una vacuna que contiene un ARNm, es decir la información genética necesaria para producir la proteína S de SARS2 dentro de las células del individuo vacunado. La vacuna se aplica en dos dosis intramusculares. La principal desventaja de esta vacuna es que debe ser transportada y conservada hasta su utilización a -80C dificultando enormemente la logística. No hay antecedentes del uso de estas vacunas en la población humana. Sin embargo, son vacunas seguras ya que su información genética no se inserta en el genoma del hospedador. Al igual que las anteriores inducen tanto respuesta humoral como celular. Estas vacunas son rápida manufactura, lo que permitiría cubrir una mayor proporción de la población.
Las tres candidatas han pasado por las fases 1 y 2 de prueba clínica en humanos, demostrando no poseer efectos adversos severos; asimismo, todas han producido niveles altos de anticuerpos neutralizantes contra SARS2 similares a los producidos tras la infección natural. La vacuna Sputnik V no ha presentado reporte de ensayo preclínico en animales.
Resultados de eficacia de los ensayos clínicos de fase 3
En los últimos días, Pfizer anunció que ha finalizado el ensayo clínico de fase 3 de su vacuna BTN162b2 (ARNm). El análisis demostró que 162 de los 170 casos confirmados de COVID-19 entre sus 43.661 participantes, habían recibido placebo, mientras que solo 8 casos positivos de COVID-19 habían recibido la vacuna. Por lo tanto, la eficacia para la BTN162b2, fue del 95%. Tanto la FDA (EE.UU.) como la OMS habían acordado avalar aquellas vacunas con eficacias iguales o mayores al 50%. Con estos resultados finales, Pfizer ha solicitado a la FDA la aprobación para el uso de emergencia de su vacuna. Por su parte, AstraZeneca dio a conocer resultados preliminares de eficacia de su vacuna AZD1222. A partir del análisis de los 131 casos positivos para COVID-19 entre el total de individuos enrolados en su respectivo ensayo (N=11.636), su vacuna demostró una eficacia promedio del 70%. Sin embargo, al analizar las eficacias particulares de los distintos grupos, de acuerdo a las dosis de vacuna que habían recibido, observaron que la eficacia de su vacuna alcanzó el 90%, cuando los individuos fueron inicialmente vacunados con la mitad de la dosis y recibieron luego, una segunda dosis completa. Durante este ensayo, un caso severo de mielitis transversa ha provocado la detención del ensayo en EE.UU. Sin embargo, el mismo ya se ha reanudado en otras regiones. Este tipo de situación es común durante la evaluación de vacunas y hablan de los rigurosos sistemas de control. Nunca la comunidad general y los medios estuvieron tan encima de estas pruebas. El principal objetivo de una vacuna es conferir protección siendo seguras. Finalmente, Moderna (mRNA-1273) y autoridades del gobierno ruso (Sputnik V) dieron a conocer resultados preliminares de sus ensayos clínicos de fase 3, demostrando eficacias mayores al 90% por parte de sus vacunas, para prevenir los cuadros clínicos de la COVID-19.
En su conjunto, estos resultados, nos permiten mirar hacia el futuro con cauto optimismo, ya que, si una vacuna protegiese al 90% de los vacunados (eficacia) y se lograra vacunar al 80% de la poblacion (cobertura), se alcanzaría una inmunidad poblacional cercana al 72%, permitiendo controlar la COVID-19.
Los anticuerpos neutralizantes como correlato de protección contra COVID-19 en personas
Otro resultado alentador que se desprende de los ensayos clínicos de vacuna para la COVID-19, es que se ha definido a la respuesta humoral de anticuerpos neutralizantes como el principal mecanismo de protección contra SARS-CoV-2 en humanos. Esta es una muy buena noticia, ya que todas las vacunas que se encuentran hoy en fase 3, han demostrado estimular este tipo de respuesta en sus respectivos ensayos preliminares. Estos resultados indican que, en un futuro cercano podríamos contar con más de una vacuna efectiva contra la COVID-19.
El desafío de lograr inmunidad poblacional
Junto con una serie de interrogantes que aún deben ser respondidos (el posible surgimiento de cepas virales resistentes, qué proporción de individuos vacunados se infectan subclínicamente, en qué medida la vacuna disminuye la transmisión del virus, los motivos por los cuales algunos individuos vacunados se infectan y presentan síntomas, cuál será la duración de la inmunidad conferida por las distintas vacunas y si los individuos de edad avanzada responderán de igual manera que los individuos jóvenes), existe otro gran desafío en puerta: lograr el acceso universal a la vacunación contra la COVID-19. A pesar de que muchas de las compañías han iniciado ya la producción masiva de sus vacunas, se estima que se demorarán meses para lograr producir los billones de dosis necesarias para vacunar a la población mundial. Además, existen una serie de dificultades relacionadas con el almacenamiento y distribución de las vacunas a los diferentes puntos de vacunación: algunas vacunas deben conservarse a -20C (Moderna, Sputnik) y -80C (Pfizer). Mantener la cadena de frio durante las etapas de distribución será otro desafío importante.
Diversos expertos coinciden en que la brecha que aún existe con respecto a la vacunación contra COVID-19, podría ser cubierta por medio de la administración directa de anticuerpos neutralizantes (nmAbs) contra el SARS-CoV-2.
¿Qué es la inmunidad pasiva y que la diferencia de la inmunidad activa?
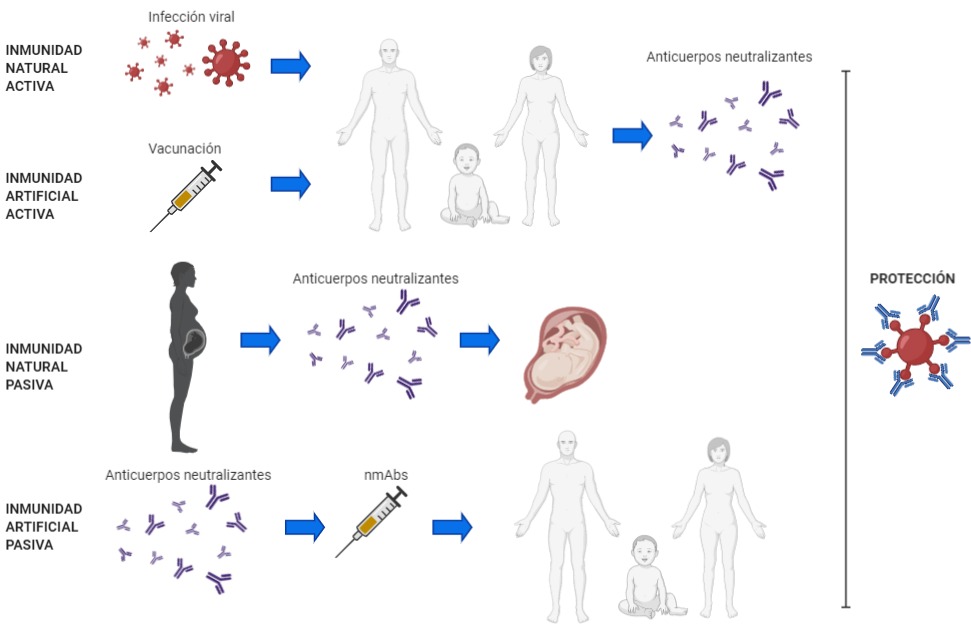
Cuando un individuo se infecta con el SARS-CoV-2, monta una respuesta inmune humoral (anticuerpos) y celular contra este virus. Este tipo de respuesta se denomina inmunidad activa. Por su parte, las vacunas contra la COVID-19, nos permiten desarrollar este tipo de respuesta inmune, sin la necesidad de atravesar la enfermedad, evitando los riesgos que ello implica. Como se hiciera mención en párrafos anteriores, distintos estudios demostraron que la protección conferida por las vacunas es mediada, al menos en parte, por los anticuerpos neutralizantes dirigidos contra la proteína S del SARS-CoV-2. Al unirse a esta proteína, presente en la superficie del virus, los anticuerpos neutralizantes bloquean la entrada del SARS-CoV-2 a las células blanco, limitando así la replicación viral. Una alternativa para conferir inmunidad, consiste en cosechar anticuerpos neutralizantes del plasma de pacientes que se han recuperado de la COVID-19 y transferirlos a pacientes recientemente infectados con el virus. Este principio, similar al que ocurre cuando una madre le transfiere inmunidad a su bebé, se denomina inmunidad pasiva (Figura 2). A diferencia de la inmunidad activa (vacunación), la inmunidad pasiva provee protección inmediata.
Figura 2. Inmunización activa y pasiva (natural y artificial)
La FDA ha aprobado recientemente la utilización de emergencia de el anticuerpo monoclonal (mAb) bamlanivimab, producido por Lilly & Co en conjunto con el Instituto Nacional de Salud (NIH, EE.UU.). Asimismo, la empresa Regeneron (EE.UU.) ha solicitado la aprobación de sus nmAbs (REGN10987 y REGN10933). Por su parte, una decena de compañías está evaluando sus respectivos nmAbs en ensayos clínicos en personas [18]. Debido a su elevado costo y la dificultad para producir a gran escala este tipo de terapia no podría ser aplicada masivamente al conjunto de la población. Sin embargo, los nmAbs podrían administrarse a individuos mayores a 65 años y/o con otros factores de riesgos, ante una eventual exposición al SARS-CoV-2. Considerando que los mAbs ejercen un efecto inmediato, neutralizando al virus en el organismo, éstos serían capaces de prevenir el desarrollo de cuadros severos de COVID-19 en estos pacientes de riesgo.
En sintonía con el arsenal de vacunas contra el SARS-CoV-2 que se encuentran en el horizonte, los nmAbs tendrían un rol protagónico en el control de la pandemia. Mientras que la vacunación masiva de la población logrará contener la propagación del virus en el mediano y largo plazo, los nmAbs, permitirían conferir protección inmediata, incluso en aquellos pacientes con dificultades para montar su propia respuesta inmune. Además de prevenir el desarrollo de cuadros severos de COVID-19 en pacientes de edad avanzada o con algún tipo de comorbilidad, la administración profiláctica de nmAbs al personal de salud, serviría para salvaguardar la vida de quienes se encuentran al frente de la batalla contra la pandemia [18].
Consideraciones finales
Las tecnologías empleadas. No es cierto que una tecnología más nueva sea más o menos segura que una vieja. En la década del 50 una vacuna a virus inactivado (tecnología más tradicional del mercado) para el RSV causó cuadros más severos en niños vacunados que en no vacunados, cuando estos se contagiaron con el mismo virus. Justamente el efecto opuesto al deseado en una campaña de vacunación. Algo similar ocurre con las vacunas experimentales de dengue. Hoy en día los motivos de tal efecto se han revelado y gracias a ello contamos con una vacuna eficaz para la prevención del RSV, causal de pneumonías severas en menores de 6 meses [19].
Sobre el nivel de protección poblacional. FDA (US) y OMS han aconsejado aprobar aquellas vacunas que arrojen efectividades mayores al 50%; aunque baja, esta cifra ayudaría a contener la propagación de la pandemia. Si una vacuna protegiese al 80% de la población (efectividad) y se lograra vacunar al 80% de la misma (cobertura) se lograría inmunizar al 64% de la población; esta cifra es menor al 70% que se estima necesario para controlar la COVID-19. Por ello será necesario mantener las medidas precautorias (barbijo, distancia, lavado de manos).
Quienes tendrán prioridad para vacunarse. En principio, personal de salud, fuerza de seguridad, personas mayores de 60 años y personas entre 18-59 años con factores de riesgo.
Conflictos de Interés
El Dr. Jaworski no posee conflictos de interés con relación a la presente publicación
Agradecimientos
Agradezco a la Dra. M.C. Peluffo quien me alentó a la realización de este manuscrito y me ayudó con las correcciones del mismo. Al Dr. P. Cahn por todo el apoyo brindado.
Financiamiento
J.P.J. posee financiamiento de la ANPCyT, FONCyT, PICT2017-0262.
Referencias
[1] Zhou P, Yang X-L, Wang X-G, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020;579:270–3. https://doi.org/10.1038/s41586-020-2012-7.
[2] Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med 2020;382:727–33. https://doi.org/10.1056/NEJMoa2001017.
[3] Johns Hopkins Coronavirus Resource Center. COVID-19 Map – Johns Hopkins Coronavirus Resource Center. Johns Hopkins COVID-19 Res Cent 2020.
[4] Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020;181:271-280.e8. https://doi.org/10.1016/j.cell.2020.02.052.
[5] Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 2020;395:565–74. https://doi.org/10.1016/S0140-6736(20)30251-8.
[6] Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China. JAMA 2020;323:1239. https://doi.org/10.1001/jama.2020.2648.
[7] Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020;395:507–13. https://doi.org/10.1016/S0140-6736(20)30211-7.
[8] Mehra MR, Desai SS, Kuy S, Henry TD, Patel AN. Cardiovascular Disease, Drug Therapy, and Mortality in Covid-19. N Engl J Med 2020;382:e102. https://doi.org/10.1056/NEJMoa2007621.
[9] Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020;395:1033–4. https://doi.org/10.1016/S0140-6736(20)30628-0.
[10] Zhou Y, Fu B, Zheng X, Wang D, Zhao C, Qi Y, et al. Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients. Natl Sci Rev 2020;7:998–1002. https://doi.org/10.1093/nsr/nwaa041.
[11] Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature 2020;581:465–9. https://doi.org/10.1038/s41586-020-2196-x.
[12] He X, Lau EHY, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med 2020;26:672–5. https://doi.org/10.1038/s41591-020-0869-5.
[13] To KK-W, Tsang OT-Y, Leung W-S, Tam AR, Wu T-C, Lung DC, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis 2020;20:565–74. https://doi.org/10.1016/S1473-3099(20)30196-1.
[14] Zhao J, Yuan Q, Wang H, Liu W, Liao X, Su Y, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis 2020. https://doi.org/10.1093/cid/ciaa344.
[15] Long Q-X, Liu B-Z, Deng H-J, Wu G-C, Deng K, Chen Y-K, et al. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med 2020;26:845–8. https://doi.org/10.1038/s41591-020-0897-1.
[16] Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 2020;181:1489-1501.e15. https://doi.org/10.1016/j.cell.2020.05.015.
[17] Vaccine Testing and Approval Process | CDC n.d. https://www.cdc.gov/vaccines/basics/test-approve.html (accessed November 9, 2020).
[18] Jaworski JP. Neutralizing monoclonal antibodies for COVID-19 treatment and prevention. Biomed J 2020. https://doi.org/10.1016/j.bj.2020.11.011.
[19] Delgado MF, Coviello S, Monsalvo AC, Melendi GA, Hernandez JZ, Batalle JP, et al. Lack of antibody affinity maturation due to poor Toll-like receptor stimulation leads to enhanced respiratory syncytial virus disease. Nat Med 2009;15:34–41. https://doi.org/10.1038/nm.1894.
[20] Health NI of. ClinicalTrials.gov. (Https://ClinicaltrialsGov/) 2017.

